
Este elementul cel mai răspândit: – în litosferă (47,3%), în hidrosferă (85,8%), în atmosferă (23,2%-masă sau 20,9%-volum)
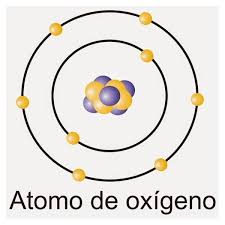
Oxigenul care este răspândit în natură este compus din trei izotopi stabili: 16O, 17O, și 18O, 16O fiind cel mai abundent (99,762% abundență natural).
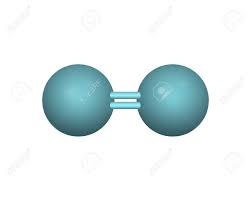
În condiţii standard, la 25 0C şi1 atm, oxigenul există sub forma de molecule diatomice O2
Oxigenul intră în compoziția multor substanțe anorganice (apă, oxizi, hidroxizi, acizi oxigenați și sărurile acestora) și în multe substanțe organice (glucoză, fructoză, zahăr, proteine, amidon, grăsimi etc.).
Oxigenul prezinta fenomenul de alotropie, (proprietatea unor elemente chimice de a prezenta două sau mai multe forme cristaline, când atomii sunt așezați diferit în funcție de legăturile chimice constituent). Acestea se numesc forme alotropice ale acelui element. Alotropul cel mai comun al oxigenului elemental se numește dioxigen O2, și are o lungime a legăturii de 121 pm și o energie de legătură de 498 kJ·mol−1. Aceasta este forma care este utilizată de forme de viață complexe, cum ar fi animalele, în respirația celulară (vezi și rolul biologic) și este forma care are o mare importanță în atmosfera Pământului . În atmosfera terestră înaltă la peste 180 km este prezent oxigenul atomic.
Trioxigenul (O3) este cunoscut de obicei sub denumirea de ozon și este un alotrop al oxigenului foarte reactiv, dăunător pentru țesutul pulmonar.
Oxigenul intră în compoziția multor substanțe anorganice (apă, oxizi, hidroxizi, acizi oxigenați și sărurile acestora) și în multe substanțe organice (glucoză, fructoză, zahăr, proteine, amidon, grăsimi etc.).
Ca proprietati fizice mentionam:
♦ gaz incolor, inodor și insipid;
♦ p.t. = -219 0C, p.f. = -183 0C;
♦ mai greu decât aerul, deci poate fi cules în vase cu gura în sus, și concentrația sa în aer scade cu cresterea altitudinii (rarefierea atmosferei); ρ0 = 1,428 g/L;
♦ parțial solubil în apă, făcând posibilă viața subacvatică;
♦ nu arde ♦ întreține viața și arderea.
Combinarea unui element cu oxigenul poartă numele de ardere. Aceste procese pot fi arderi vii, când au loc cu degajare mare de căldură şi lumină şi pot fioxidări sau arderi lente, care se petrec la temperaturi joase şi cu viteză mică
Oxidările lente se petrec în organismele vii şi sunt esenţiale pentru viaţa acestora.Dintre nemetale, ard deosebit de uşor fosforul alb, sulful şi carbonul, formând oxizi: P 2O5, SO2 şi CO2.
Dintre metale, cel mai uşor arde magneziul, emiţând lumină albă şi căldură. Arderile constituie o sursă important de energie.
Intrebuintari
Oxigenul intretine viata si arderea. Se utilizeaza in medicina, aparat autonom de respirat sub apa in circuit inchis pentru scafandri de lupta, albirea tesaturilor, sudura, taierea metalelor, sinteza acizilor, motoare, obtinerea experimentelor. Oxigenul medicinal este utilizat pe scară largă în fiecare structură de asistenţă medicală, cu aplicaţii de la anestezie până la terapia prin inhalaţie.
